快速通关!中山一院伦理初始审查实用指南
想让您的项目伦理初始审查更顺畅、更高效吗?本文总结了伦理初始审查的常见问题和关键经验,助您精准避坑,一次过审!
一、通关第一步:摸清基础规则
(一)要求哪里查?
中山大学附属第一医院医学伦理委员会专题网站里有详细的审查要求,从流程到文件要求都写得明明白白,一定要提前阅读!
伦理官网:https://iec.fahsysu.org.cn/
(二)文件怎么交?
需要同步在CTMS系统上传电子版文件和线下提交纸质文件。请认真阅读《伦理初始审查申请送审文件清单》并按要求提交送审文件。
CTMS系统伦理模块
(三)时间要卡准!
我院伦理审查一般每月2次,至少提前1周递交形审纸质版资料。最新伦理审查会议安排可以登录我院伦理官网或我院药物临床试验机构官网/公众号查询。
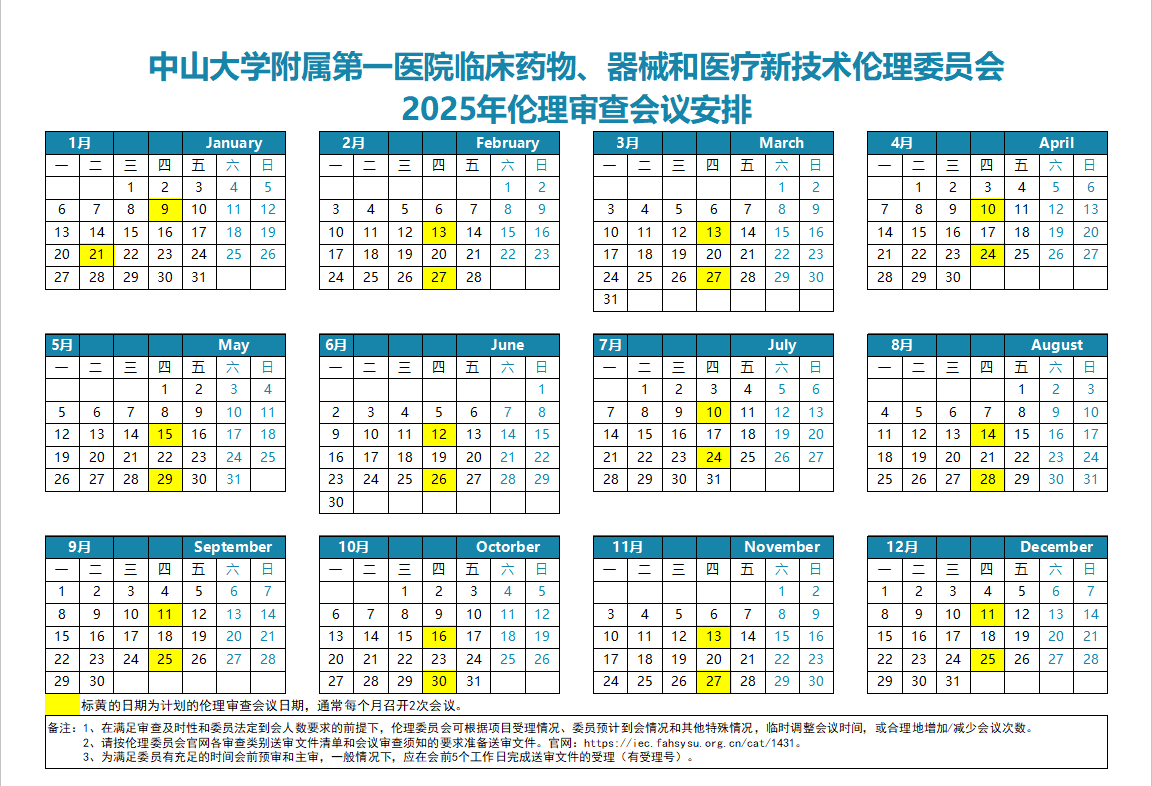
2025年伦理审查会议安排
(四)疑问怎么办?
请仔细阅读伦理官网中“初始审查申请”相关文件,未提及或不明白事宜可邮件/电话/当面咨询伦理委员会。
地址:广东省广州市竹丝岗二马路5号龙珠大厦写字楼1楼110房
联系人:林颖/黄树珊
电话:020-87330631(FAX)
邮箱:zsyyiec2020@mail.sysu.edu.cn
二、避坑宝典:资料准备关键细节
(一)递交信
- 使用模板:《递交信送审文件目录》尽量使用伦理官网的模板。
- 注意备注要求:注意《递交信送审文件目录》中对版本信息和备注信息的要求。
(1)临床试验通知书要写编号

(2)保险凭证要标保险期限

(3)中心实验室检测项目明细及检测结果返回中心的时限(中心实验室报告)要加实验室名称

(二)知情同意书(ICF)
1. 采血量:
应明确告知访视的次数和间隔,对于需要取血的,应告知取血的频度和总量(包括每阶段的采血量或者总的采血量、PK/ADA采血)。特别不要遗漏对检查血总量的描述!
2.中心实验室:
(1)名称描述:告知具体的中心实验室(中心实验室名称与送审文件提交的一致)。
(2)结果时限:注意核对知情同意书、方案、中心实验室检测项目明细及检测结果返回中心的时限,并且保持一致性。
3.保险:
(1)应明确临床试验相关损害赔偿的责任方为申办者,而不是保险。
(2)若购买的保险被保人是申办者,则应避免描述“为受试者提供保险”,而应该描述为“申办方购买了临床试验责任保险”。
4.补偿
(1)应明确受试者补贴的发放频率、方式、金额。
(2)应明确研究药物、对照药物、背景药物是否免费发放。
(3)建议明确告知是分次支付的(如适用)
5.联系方式
不同的问题可能需要联系不同的部门或人员,应分开写清楚,例如
(1)受试者权益相关的疑问:联系伦理委员会,伦理委员会联系方式建议写电话。
(2)与研究相关的其他疑问:联系研究者。
6.角色名称
各个角色的名称需与GCP中的描述一致
(1)受试者,研究参与者(非“患者”等其他称谓,特别是签字栏)
(2)监护人(非“法定代理人”等描述)。
(3)公正见证人(非“公证人”等描述)。
(三)CTMS 系统
1. 文件命名要统一:文件命名和递交信中的命名保持一致。
2.多个文件打包传:一项下有多个文件时,建议上传压缩包,并按照递交信顺序排序。
3.文件顺序别搞错:上传文件的顺序与递交信保持一致。
4.修改后要记得保存:伦理初始审查申请表要记得保存每次修改后,还需在“送审文件清单”页面点击保存。
5.注意缺陷提醒:伦理初始审查申请表填写时可注意右上角缺陷的提醒。
(四)伦理初始审查送审文件自查表
《伦理初始审查送审文件自查表》涵盖了高频问题点。认真使用该自查表进行自查,有助于提前发现并修正问题。站在伦理的角度思考问题,将有助于更准确地完善资料。
三、高效通过秘诀:一次做对,主动沟通!
- 精读要求,仔细核对: 拿出“找茬”的精神,逐字逐句对照伦理要求检查文件;
- 站在伦理角度自检:理解为什么有这些要求,改起来更精准;
- 主动沟通>被动修改:对反馈意见有疑问?别瞎猜!和伦理老师沟通清楚后再修改,避免反复修改浪费时间;
- 最高效的办法:一次做对!首次提交就力求完美,才是最省时间、最不耽误项目进度的方法。
觉得有用的话,转发给身边的小伙伴一起高效通关伦理初始审查吧!祝您的项目顺利启航!




